
This activity is provided by Med Learning Group.
This activity is supported by an educational grant from Lilly.
Copyright © 2024 Med Learning Group. Built by Divigner. All Rights Reserved.
No existe una cura para la enfermedad de Alzheimer (EA); sin embargo, la progresión de la enfermedad puede ser alterada con opciones de tratamiento no farmacológicas y farmacológicas.1,2 La EA es una afección neurodegenerativa que generalmente empeora con el tiempo, y los tratamientos son generalmente más efectivos en la etapa temprana del proceso de la enfermedad.3
Las intervenciones no farmacológicas no cambian el curso subyacente de la enfermedad, sin embargo, a menudo se implementan para ayudar a mantener o mejorar la función cognitiva, así como para reducir los síntomas conductuales.2 Estas intervenciones pueden incluir estimulación cognitiva, terapia basada en la música, tratamiento psicológico (es decir, terapia cognitivo-conductual), terapia física/ejercicio y una dieta saludable.2,3 La seguridad, eficacia y pureza de terapias/suplementos alternativos es en gran parte desconocida, aunque se están realizando ensayos para evaluar la efectividad de algunos “alimentos médicos”, como los triglicéridos de cadena media.4
Los pilares de la terapia farmacológica se centran en manejar temporalmente los síntomas de la EA o tratar la causa subyacente de la enfermedad.5,6 En términos de terapia farmacológica, hasta la fecha siete medicamentos han recibido la aprobación de la FDA de EE. UU. para el tratamiento de la EA. Estos incluyen tres inhibidores de la acetilcolinesterasa (donepezil, rivastigmina y galantamina), un antagonista del N-metil-D-aspartato [NMDA] (memantina), una combinación de medicamentos (memantina más donepezil) y dos terapias modificadoras de la enfermedad (aducanumab y lecanemab).2
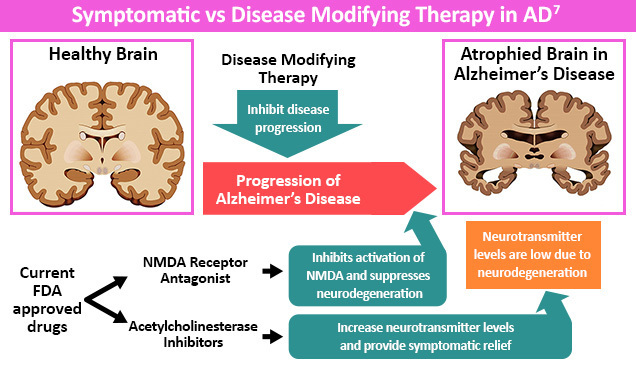
Las personas con EA tienen una función colinérgica disminuida debido a la disminución de la síntesis de acetilcolina.1 Los inhibidores de la colinesterasa, como donepezil, rivastigmina y galantamina, pueden aumentar la transmisión colinérgica llevando a una mejora en los síntomas de EA.1
Las personas con todas las etapas de EA pueden beneficiarse de un ensayo de inhibidores de la colinesterasa, ya que pueden mostrar un pequeño beneficio en la cognición, los síntomas neuropsiquiátricos y las actividades de la vida diaria (AVD).1 Sin embargo, los resultados pueden ser variables, ya que los estudios sugieren que no se observa ningún beneficio observable en hasta el 30%-50% de las personas con EA.1 Por otro lado, hasta el 20% de las personas pueden ver una mejora por encima del promedio en los síntomas.1 Los efectos secundarios de los inhibidores de la colinesterasa incluyen náuseas, vómitos, diarrea, trastornos del sueño, bradicardia, defectos en la conducción cardíaca y síncope.3 Además, evitar los antidepresivos tricíclicos para el tratamiento de la ansiedad, la depresión y la psicosis es clave debido a su actividad anticolinérgica.3
La memantina es otra opción terapéutica para la EA que se puede administrar como monoterapia o en combinación con inhibidores de la colinesterasa.3 Este agente actúa bloqueando la estimulación patológica de los receptores NMDA por el neurotransmisor glutamato y retardando la acumulación intracelular de calcio.1,2,3 Este mecanismo de acción distinto se considera neuroprotector contra el glutamato y puede restaurar la función neuronal fisiológica.1,2 Los estudios también sugieren que la memantina puede proporcionar a los pacientes una pequeña mejora en la cognición, la demencia y la calidad de vida.1 Los efectos secundarios comunes de la memantina incluyen mareos, dolores corporales, dolor de cabeza y estreñimiento.3
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) ha aprobado aducanumab (2021) y lecanemab (2023) a través de un proceso de aprobación acelerada.8,9 Aducanumab es un anticuerpo monoclonal recombinante que apunta a la amiloide-beta (ensayos EMERGE y ENGAGE) aprobado para personas con deterioro cognitivo leve (DCL) y la etapa de demencia leve de la EA, pero se recomienda limitar su uso a aquellos con patología de amiloide documentada en escáneres de tomografía por emisión de positrones (PET) de amiloide.1,2,7,10 Aducanumab está asociado con un mayor riesgo de anomalías en la imagen relacionadas con el amiloide (ARIA), que pueden ser un indicador de inflamación cerebral; se requieren ensayos posteriores a la aprobación para verificar el beneficio clínico.1,2 Sin embargo, cabe señalar que aducanumab se está descontinuando en 2024. El fabricante, Biogen, ha declarado que los pacientes que actualmente están recibiendo el medicamento como parte de un ensayo clínico continuarán teniendo acceso a él hasta el 1 de mayo de 2024, y aquellos que reciban aducanumab a través de receta médica de sus medicos tratantes lo tendrán disponible hasta el 1 de noviembre de 2024.7 Lecanemab es otro anticuerpo monoclonal que apunta a los protofibrilos de β-amiloide (CLARITY-AD), con indicaciones aprobadas de uso en aquellos con DCL y la etapa de demencia leve de la EA, después de la presencia confirmada de patología de amiloide-beta.5,11 También se han asociado eventos de ARIA con lecanemab; se requieren ensayos posteriores a la aprobación para verificar el beneficio clínico.5
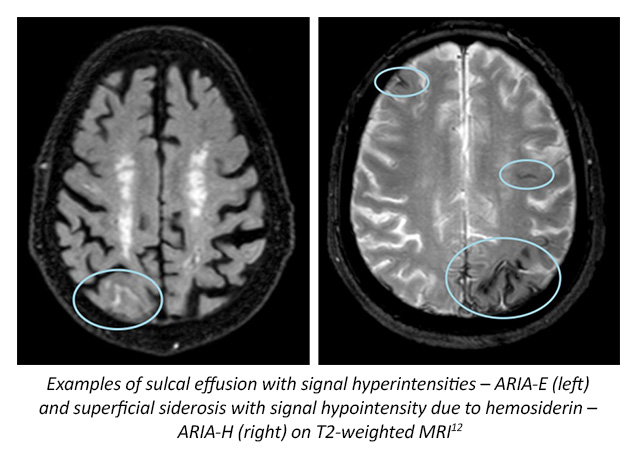
En la actualidad, un total de 36 agentes están siendo evaluados en 55 ensayos clínicos diferentes de EA, entre los cuales los agentes modificadores de la enfermedad comprenden el 67%.13 Una opción de tratamiento emergente para la EA es donanemab, también un anticuerpo monoclonal que apunta al epítopo de pirroglutamato N-terminal, una forma modificada de amiloide-beta presente solo en placas establecidas.14,15 Los ensayos clínicos sugieren que este nuevo medicamento no solo reduce las placas de amiloide según lo medido por la captación de 18 F-florbetapir en PET, sino que también reduce los niveles de biomarcadores de tau plasmática (ensayos TRAILBLAZER-ALZ y TRAILBLAZER-ALZ2).14,15 Donanemab también ha demostrado tener menos declive cognitivo y funcional en comparación con el placebo.14 También se ha observado ARIA con el uso de donanemab en el entorno de ensayos clínicos.14
Otro tratamiento en la línea de investigación incluye gantenerumab, un anticuerpo monoclonal que apunta a la amiloide-beta.16 Gantenerumab se une a las placas de amiloide beta agregadas por fagocitosis, y también mostró una disminución robusta en las placas de amiloide después de 2 años de tratamiento.16
Los objetivos de manejo para la EA incluyen la estrategia para optimizar los resultados de la demencia, centrándose en disminuir los síntomas y mantener la calidad de vida a través de la maximización de la función, cognición, comportamiento y seguridad.20 Un enfoque multidisciplinario y un modelo de atención colaborativa se centran en enfoques sistemáticos a largo plazo para el manejo de condiciones crónicas como la EA, posiblemente utilizando estrategias rentables para mejorar los resultados de salud y la toma de decisiones compartidas para el tratamiento individualizado.21 Este equipo puede ayudar a facilitar la adaptación a los cambios cognitivos y conductuales con la progresión de la enfermedad, así como referir para la participación en ensayos clínicos relacionados con la demencia.20,22 También se pueden discutir problemas no medicos relacionados con la planificación del cuidado a largo plazo para las necesidades cambiantes a lo largo de la EA, como establecer un poder de representación en asuntos de salud, crear un testamento vital, determinar las preferencias de atención al final de la vida y revisar las finanzas.18
Todos los URLs fueron accedidos el 14 de febrero de 2024.

This activity is provided by Med Learning Group.
This activity is supported by an educational grant from Lilly.
Copyright © 2024 Med Learning Group. Built by Divigner. All Rights Reserved.
Esta actividad es proporcionada por Med Learning Group. Esta actividad es co-proporcionada por Ultimate Medical Academy / Complete Conference Management (CCM).
Esta actividad está respaldada por una beca de educación médica independiente de Regeneron Pharmaceuticals, Inc.

Copyright © 2019 Med Learning Group. Construido por Divigner. Reservados todos los derechos.

Profesora Distinguida de la Universidad de Indiana
Profesora Barbara and Peer Baekgaard de Investigación sobre la Enfermedad de Alzheimer
Profesora en Neurología, Radiología, Medicina y Genética Molecular
Facultad de Medicina de la Universidad de Indiana
Departamento de Neurología
Indianapolis, IN

Director, Instituto de Investigación de Salud Banner Sun
Salud de la bandera
Sun City, AZ
Profesor de Neurología, Centro de Medicina Cerebral/Mente
Brigham and Women's Hospital y Harvard Medical School
Boston, MA

Director del programa, AdventHealth Geriatric Fellowship
Winter Park, FL

Directora Unidad de Trastornos Frontotemporales
Hospital General de Massachusetts
Profesor de neurología, escuela de medicina de harvard
Boston, MA

Profesor Clínico de Medicina
Facultad de Medicina de la Universidad de Tufts
Profesor clínico, Departamento de Salud Pública y Medicina Comunitaria, Universidad Tufts
Jefe, Servicio de Geriatría, Tufts Medical Center
Médico principal, Centro de diagnóstico Pratt
Decano ex officio, Oficina de Asuntos Internacionales, Facultad de Medicina de la Universidad de Tufts
Boston, MA

Profesor de neurologia
Facultad de Medicina Miller de la Universidad de Miami
Miami, FL

Profesor y Director
División de Trastornos de la Memoria y Neurología del Comportamiento
Departamento de Neurología
Escuela de Medicina de Heersink
Universidad de Alabama en Birmingham
Birmingham, Alabama

Profesor y Director, División de Psiquiatría Geriátrica
Departamento de Psiquiatría y Neurociencia del Comportamiento
Facultad de Medicina de la Universidad de Saint Louis
San Luis, MO

Director de Salud Cognitiva Geriátrica
Instituto de Neurociencias del Pacífico
Santa Monica, CA

Presidente, Centro Médico Kerwin
Jefe, Medicina Geriátrica, Texas Health Presbyterian Hospital
Dallas, TX

Profesor Asistente de Neurología, Facultad de Medicina de Harvard
Centro de Investigación y Tratamiento del Alzheimer
Hospital Brigham y de Mujeres
Unidad de Trastornos Frontotemporales
Hospital General de Massachusetts
Boston, MA

Presidente de la familia Saunders y profesor de neurología
Director del Centro de Neuroresiliencia Integrativa Molecular,
Catedrático de Psiquiatría y Neurociencias
Catedrático de Geriatría y Desarrollo de Adultos
Departamento de Neurología e Instituto del Cerebro Friedman
Escuela de Medicina Icahn en Mount Sinai
Nueva York, NY

Catedrático de Neurología
División de Alzheimer y Trastornos de la Memoria
Director Asociado del Programa de Investigación-Residencia en Neurología
Instituto Neurológico Barrow
Profesor de Investigación, Facultad de Medicina de la Universidad de Arizona-Phoenix
Profesor Clínico de Neurología, Universidad de Creighton
Phoenix, Arizona

Profesor Rick McCord en Neurología
Profesor de la familia Umphrey de enfermedades neurodegenerativas
Director, Centro de Trastornos Neurocognitivos
Director, Beca de Trastornos Neurocognitivos
Escuela de Medicina McGovern en UTHealth Houston
Houston, TX

Presidente Distinguido John R. Ellis de Práctica Farmacéutica
Profesor de Ciencias Clínicas
Director, Drake Drug Information Center
Facultad de Farmacia y Ciencias de la Salud de la Universidad Drake
Farmacéutico Clínico de Medicina Interna
Centro Médico Metodista de Iowa
Des Moines, IA

Profesor de Neurología
Director, Centro de Investigación de la Enfermedad de Alzheimer de Penn
Universidad de Pensilvania
Filadelfia, PA